पेप्टाइड्स पेप्टाइड बॉन्ड के माध्यम से कई अमीनो एसिड के कनेक्शन द्वारा गठित यौगिकों का एक वर्ग है। वे जीवित जीवों में सर्वव्यापी हैं। अब तक, जीवित जीवों में दसियों हज़ार पेप्टाइड्स पाए गए हैं। पेप्टाइड्स विभिन्न प्रणालियों, अंगों, ऊतकों और कोशिकाओं और जीवन गतिविधियों में कार्यात्मक गतिविधियों को विनियमित करने में महत्वपूर्ण भूमिका निभाते हैं, और अक्सर कार्यात्मक विश्लेषण, एंटीबॉडी अनुसंधान, दवा विकास और अन्य क्षेत्रों में उपयोग किए जाते हैं। जैव प्रौद्योगिकी और पेप्टाइड संश्लेषण प्रौद्योगिकी के विकास के साथ, अधिक से अधिक पेप्टाइड दवाओं को क्लिनिक में विकसित और लागू किया गया है।
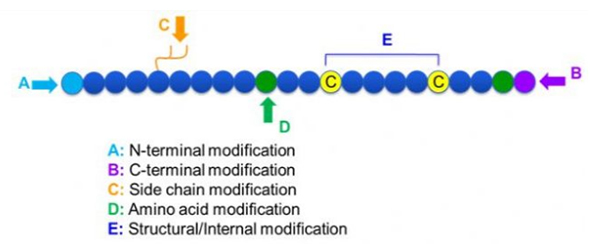
पेप्टाइड संशोधनों की एक विस्तृत विविधता हैं, जिन्हें केवल पोस्ट संशोधन और प्रक्रिया संशोधन (व्युत्पन्न अमीनो एसिड संशोधन का उपयोग करके), और एन-टर्मिनल संशोधन, सी-टर्मिनल संशोधन, साइड चेन संशोधन, एमिनो एसिड संशोधन, कंकाल संशोधन, आदि में विभाजित किया जा सकता है, जो संशोधन साइट (चित्रा 1) के आधार पर है। पेप्टाइड श्रृंखलाओं के मुख्य श्रृंखला संरचना या साइड चेन समूहों को बदलने के लिए एक महत्वपूर्ण साधन के रूप में, पेप्टाइड संशोधन प्रभावी रूप से पेप्टाइड यौगिकों के भौतिक और रासायनिक गुणों को बदल सकता है, पानी की घुलनशीलता को बढ़ा सकता है, विवो में कार्रवाई के समय को लम्बा कर सकता है, उनके जैविक वितरण को बदल सकता है, इम्युनोजेनेसिटी को समाप्त करता है, इस पेपर में विषाक्त साइड इफेक्ट्स को कम करता है, कई प्रमुख पेप्टाइड मॉडिफिकेशन रणनीतियाँ और उनकी विशेषताएं परिचित हैं।
1। चक्रवात
चक्रीय पेप्टाइड्स में बायोमेडिसिन में कई अनुप्रयोग होते हैं, और जैविक गतिविधि के साथ कई प्राकृतिक पेप्टाइड्स चक्रीय पेप्टाइड्स होते हैं। क्योंकि चक्रीय पेप्टाइड्स रैखिक पेप्टाइड्स की तुलना में अधिक कठोर होते हैं, वे पाचन तंत्र के लिए बेहद प्रतिरोधी होते हैं, पाचन तंत्र में जीवित रह सकते हैं, और लक्ष्य रिसेप्टर्स के लिए एक मजबूत आत्मीयता प्रदर्शित कर सकते हैं। चक्रवात चक्रीय पेप्टाइड्स को संश्लेषित करने का सबसे सीधा तरीका है, विशेष रूप से बड़े संरचनात्मक कंकाल के साथ पेप्टाइड्स के लिए। चक्रीय मोड के अनुसार, इसे साइड चेन -साइड चेन प्रकार, टर्मिनल - साइड चेन प्रकार, टर्मिनल - टर्मिनल प्रकार (अंत से अंत प्रकार) में विभाजित किया जा सकता है।
(१) सिडचैन-टू-साइडचैन
साइड-चेन साइक्लाइज़ेशन के लिए साइड-चेन का सबसे आम प्रकार सिस्टीन अवशेषों के बीच ब्रिजिंग है। इस चक्रवात को सिस्टीन अवशेषों की एक जोड़ी द्वारा पेश किया जाता है और फिर डाइसल्फ़ाइड बॉन्ड बनाने के लिए ऑक्सीकरण किया जाता है। पॉलीसाइक्लिक संश्लेषण को सल्फहाइड्रिल संरक्षण समूहों के चयनात्मक हटाने द्वारा प्राप्त किया जा सकता है। साइकिलकरण या तो पोस्ट-डिसोसिएशन विलायक या प्री-डिसोसिएशन राल पर किया जा सकता है। रेजिन पर साइकिलकरण विलायक चक्रवात की तुलना में कम प्रभावी हो सकता है क्योंकि रेजिन पर पेप्टाइड्स आसानी से साइकिलाइड अनुरूपता नहीं बनाते हैं। एक अन्य प्रकार की साइड -चेन - साइड चेन साइक्लाइज़ेशन एक एस्पार्टिक एसिड या ग्लूटामिक एसिड अवशेषों और बेस एमिनो एसिड के बीच एक एमाइड संरचना का गठन है, जिसके लिए आवश्यक है कि साइड चेन प्रोटेक्शन ग्रुप को राल पर या विघटन के बाद पॉलीपेप्टाइड से चुनिंदा रूप से हटा दिया जाना चाहिए। तीसरे प्रकार के साइड-चेन-साइड चेन साइक्लाइजेशन टायरोसिन या पी-हाइड्रॉक्सीफेनिलग्लाइसिन द्वारा डिपेनिल इथर का गठन है। प्राकृतिक उत्पादों में इस प्रकार का चक्रवात केवल माइक्रोबियल उत्पादों में पाया जाता है, और चक्रवात उत्पादों में अक्सर संभावित औषधीय मूल्य होता है। इन यौगिकों की तैयारी के लिए अद्वितीय प्रतिक्रिया स्थितियों की आवश्यकता होती है, इसलिए वे अक्सर पारंपरिक पेप्टाइड्स के संश्लेषण में उपयोग नहीं किए जाते हैं।

(२) टर्मिनल-टू-साइडचैन
टर्मिनल-साइड चेन साइकिलाइजेशन में आमतौर पर लाइसिन या ऑर्निथिन साइड चेन के एमिनो समूह के साथ सी-टर्मिनल या एस्पार्टिक एसिड या ग्लूटामिक एसिड साइड चेन के साथ एन-टर्मिनल शामिल होता है। अन्य पॉलीपेप्टाइड चक्रवात टर्मिनल सी और सेरीन या थ्रेओनीन साइड चेन के बीच ईथर बॉन्ड बनाकर बनाया जाता है।
(3) टर्मिनल या हेड-टू-टेल प्रकार
चेन पॉलीपेप्टाइड्स को या तो एक विलायक में साइकिल चलाया जा सकता है या साइड चेन साइक्लसाइड द्वारा राल पर तय किया जा सकता है। पेप्टाइड्स के कम सांद्रता का उपयोग विलायक केंद्रीकरण में किया जाना चाहिए ताकि पेप्टाइड्स के ऑलिगोमेराइजेशन से बचें। हेड-टू-टेल सिंथेटिक रिंग पॉलीपेप्टाइड की उपज श्रृंखला पॉलीपेप्टाइड के अनुक्रम पर निर्भर करती है। इसलिए, बड़े पैमाने पर चक्रीय पेप्टाइड्स तैयार करने से पहले, संभावित जंजीर लीड पेप्टाइड्स की एक लाइब्रेरी को पहले बनाया जाना चाहिए, इसके बाद साइकिलकरण द्वारा सर्वोत्तम परिणामों के साथ अनुक्रम खोजने के लिए।
2। एन-मिथाइलेशन
एन-मिथाइलेशन मूल रूप से प्राकृतिक पेप्टाइड्स में होता है और हाइड्रोजन बॉन्ड के गठन को रोकने के लिए पेप्टाइड संश्लेषण में पेश किया जाता है, जिससे पेप्टाइड्स बायोडिग्रेडेशन और क्लीयरेंस के लिए अधिक प्रतिरोधी बन जाते हैं। एन-मिथाइलेटेड एमिनो एसिड डेरिवेटिव का उपयोग करके पेप्टाइड्स का संश्लेषण सबसे महत्वपूर्ण तरीका है। इसके अलावा, एन- (2-नाइट्रोबेंजीन सल्फोनील क्लोराइड) की मित्सुनोबु प्रतिक्रिया, मेथनॉल के साथ पॉलीपेप्टाइड-रेजिन इंटरमीडिएट का भी उपयोग किया जा सकता है। इस विधि का उपयोग चक्रीय पेप्टाइड पुस्तकालयों को एन-मिथाइलेटेड अमीनो एसिड से युक्त करने के लिए किया गया है।
3। फॉस्फोराइलेशन
फॉस्फोराइलेशन प्रकृति में सबसे आम पोस्ट-ट्रांसलेशनल संशोधनों में से एक है। मानव कोशिकाओं में, 30% से अधिक प्रोटीन फॉस्फोराइलेटेड होते हैं। फॉस्फोराइलेशन, विशेष रूप से प्रतिवर्ती फॉस्फोराइलेशन, कई सेलुलर प्रक्रियाओं को नियंत्रित करने में महत्वपूर्ण भूमिका निभाता है, जैसे सिग्नल ट्रांसडक्शन, जीन अभिव्यक्ति, सेल चक्र और साइटोस्केलेटन विनियमन, और एपोप्टोसिस।
फॉस्फोराइलेशन को विभिन्न प्रकार के अमीनो एसिड अवशेषों पर देखा जा सकता है, लेकिन सबसे आम फॉस्फोराइलेशन लक्ष्य सेरीन, थ्रेओनीन और टायरोसिन अवशेष हैं। फॉस्फोटायरोसिन, फॉस्फोथ्रोनिन, और फॉस्फोसेरिन डेरिवेटिव को या तो संश्लेषण के दौरान पेप्टाइड्स में पेश किया जा सकता है या पेप्टाइड संश्लेषण के बाद गठन किया जा सकता है। चयनात्मक फॉस्फोराइलेशन को सेरीन, थ्रेओनीन और टायरोसिन के अवशेषों का उपयोग करके प्राप्त किया जा सकता है जो चुनिंदा रूप से सुरक्षात्मक समूहों को हटाते हैं। कुछ फॉस्फोराइलेशन अभिकर्मक भी पोस्ट संशोधन द्वारा पॉलीपेप्टाइड में फॉस्फोरिक एसिड समूहों को पेश कर सकते हैं। हाल के वर्षों में, लाइसिन के साइट-विशिष्ट फॉस्फोराइलेशन को रासायनिक रूप से चयनात्मक स्टैडिंगर-फॉस्फाइट प्रतिक्रिया (चित्रा 3) का उपयोग करके प्राप्त किया गया है।

4। myristoylation और palmitoylation
फैटी एसिड के साथ एन-टर्मिनल का एसाइलेशन पेप्टाइड्स या प्रोटीन को कोशिका झिल्ली से बांधने की अनुमति देता है। एन-टर्मिनल पर Myridamoylated अनुक्रम SRC परिवार प्रोटीन किनेसेस और रिवर्स ट्रांसक्रिपटेस GAQ प्रोटीन को कोशिका झिल्ली को बांधने के लिए लक्षित करने में सक्षम बनाता है। Myristic एसिड को मानक युग्मन प्रतिक्रियाओं का उपयोग करके राल-पॉलीपेप्टाइड के एन-टर्मिनल से जोड़ा गया था, और परिणामी लिपोपेप्टाइड को मानक परिस्थितियों में अलग किया जा सकता है और आरपी-एचपीएलसी द्वारा शुद्ध किया जा सकता है।
5। ग्लाइकोसिलेशन
वैनकोमाइसिन और टेइकोलैनिन जैसे ग्लाइकोपेप्टाइड्स दवा प्रतिरोधी बैक्टीरियल संक्रमणों के उपचार के लिए महत्वपूर्ण एंटीबायोटिक हैं, और अन्य ग्लाइकोपेप्टाइड्स का उपयोग अक्सर प्रतिरक्षा प्रणाली को उत्तेजित करने के लिए किया जाता है। इसके अलावा, चूंकि कई माइक्रोबियल एंटीजन ग्लाइकोसिलेटेड हैं, इसलिए संक्रमण के चिकित्सीय प्रभाव में सुधार के लिए ग्लाइकोपेप्टाइड्स का अध्ययन करना बहुत महत्वपूर्ण है। दूसरी ओर, यह पाया गया है कि ट्यूमर कोशिकाओं के कोशिका झिल्ली पर प्रोटीन असामान्य ग्लाइकोसिलेशन को प्रदर्शित करते हैं, जो ग्लाइकोपेप्टाइड्स को कैंसर और ट्यूमर प्रतिरक्षा रक्षा अनुसंधान में एक महत्वपूर्ण भूमिका निभाता है। ग्लाइकोपेप्टाइड्स FMOC/T-BU विधि द्वारा तैयार किए जाते हैं। ग्लाइकोसिलेटेड अवशेष, जैसे कि थ्रेओनीन और सेरीन, को अक्सर पेंटाफ्लुओरोफेनोल एस्टर द्वारा ग्लाइकोसिलेटेड एमिनो एसिड की रक्षा के लिए Pentafluorophenol एस्टर सक्रिय FMOCs द्वारा पॉलीपेप्टाइड्स में पेश किया जाता है।
6। आइसोप्रीन
सी-टर्मिनल के पास साइड चेन में सिस्टीन अवशेषों पर आइसोपेंटाडिएनिलेशन होता है। प्रोटीन आइसोप्रीन सेल झिल्ली आत्मीयता में सुधार कर सकता है और प्रोटीन-प्रोटीन इंटरैक्शन बना सकता है। Isopentadienated प्रोटीन में टायरोसिन फॉस्फेट, छोटे GTase, कोकैपरोन अणु, परमाणु लामिना और सेंट्रोमेरिक बाइंडिंग प्रोटीन शामिल हैं। आइसोप्रीन पॉलीपेप्टाइड्स को रेजिन पर आइसोप्रीन का उपयोग करके या सिस्टीन डेरिवेटिव का उपयोग करके तैयार किया जा सकता है।
7। पॉलीथीन ग्लाइकोल (पीईजी) संशोधन
PEG संशोधन का उपयोग प्रोटीन हाइड्रोलाइटिक स्थिरता, बायोडिस्ट्रेशन और पेप्टाइड घुलनशीलता में सुधार करने के लिए किया जा सकता है। पेप्टाइड्स के लिए खूंटी श्रृंखलाओं की शुरूआत उनके औषधीय गुणों में सुधार कर सकती है और प्रोटियोलिटिक एंजाइमों द्वारा पेप्टाइड्स के हाइड्रोलिसिस को भी रोक सकती है। खूंटी पेप्टाइड्स ग्लोमेरुलर केशिका क्रॉस सेक्शन से गुजरते हैं जो साधारण पेप्टाइड्स की तुलना में अधिक आसानी से होता है, जिससे गुर्दे की निकासी को बहुत कम होता है। विवो में खूंटी पेप्टाइड्स के विस्तारित सक्रिय आधा जीवन के कारण, सामान्य उपचार स्तर को कम खुराक और कम लगातार पेप्टाइड दवाओं के साथ बनाए रखा जा सकता है। हालांकि, PEG संशोधन के नकारात्मक प्रभाव भी होते हैं। बड़ी मात्रा में खूंटी एंजाइम को पेप्टाइड को नीचा दिखाने से रोकती है और पेप्टाइड के बाध्यकारी को लक्ष्य रिसेप्टर के लिए भी कम करती है। लेकिन पेग पेप्टाइड्स की कम आत्मीयता आमतौर पर उनके लंबे समय तक फार्माकोकाइनेटिक आधा जीवन से ऑफसेट होती है, और शरीर में लंबे समय तक मौजूद होने से, पेग पेप्टाइड्स को लक्ष्य ऊतकों में अवशोषित होने की अधिक संभावना होती है। इसलिए, पीईजी बहुलक विनिर्देशों को इष्टतम परिणामों के लिए अनुकूलित किया जाना चाहिए। दूसरी ओर, पेग पेप्टाइड्स कम गुर्दे की निकासी के कारण यकृत में जमा होते हैं, जिसके परिणामस्वरूप मैक्रोमोलेक्यूलर सिंड्रोम होता है। इसलिए, पीईजी संशोधनों को अधिक सावधानी से डिज़ाइन करने की आवश्यकता होती है जब पेप्टाइड्स का उपयोग दवा परीक्षण के लिए किया जाता है।

Common modification groups of PEG modifiers can be roughly summarized as follows: Amino (-amine) -NH2, aminomethyl-Ch2-NH2, hydroxy-OH, carboxy-Cooh, sulfhydryl (-Thiol) -SH, Maleimide -MAL, succinimide carbonate -SC, succinimide acetate -SCM, succinimide propionate -SPA, N-hydroxysuccinimide -nhs, acrylate-ch2ch2cooh, aldehyde -cho (जैसे कि प्रोपल-एलएएल, ब्यूटिराल्ड), ऐक्रेलिक बेस (-एक्लैट-एसीआरएल), एज़िडो-एज़ाइड, बायोटिनिल-बॉक, फ्लोरिसिन, एसी, एसी, एसी, एसी, एसी, एसी, एसी, एसी। P -toluenesulfonate -ots, succinimide succinate -ss, आदि। कार्बोक्जिलिक एसिड के साथ PEG डेरिवेटिव को N- टर्मिनल एमाइन या लाइसिन साइड चेन में जोड़ा जा सकता है। एमिनो-सक्रिय खूंटी को एस्पार्टिक एसिड या ग्लूटामिक एसिड साइड चेन के लिए युग्मित किया जा सकता है। MAL-ACTIVATED PEG को पूरी तरह से डिप्रोटेक्टेड सिस्टीन साइड चेन [11] के मर्कैप्टेन के लिए संयुग्मित किया जा सकता है। PEG Modifiers को आमतौर पर निम्नानुसार वर्गीकृत किया जाता है (नोट: MPEG मेथॉक्सी-पेग है, CH3O- (CH2CH2O) N-CH2CH2-OH):
(1) सीधे श्रृंखला खूंटी संशोधक
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-OTS, MPEG-SH, MPEG-ALD, MPEG-BUTYRALD, MPEG-SS
(२) द्विभाजक खूंटी संशोधक
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCL · NH2-PEG-COOH, MAL-PEG-NHS
(३) ब्रांचिंग खूंटी संशोधक
(MPEG) 2-NHS, (MPEG) 2-ALD, (MPEG) 2-NH2, (MPEG) 2-मल
8। बायोटिनाइजेशन
बायोटिन को एविडिन या स्ट्रेप्टाविडिन के साथ दृढ़ता से बाध्य किया जा सकता है, और बाध्यकारी ताकत सहसंयोजक बंधन के करीब भी है। बायोटिन-लेबल वाले पेप्टाइड्स का उपयोग आमतौर पर इम्युनोसे, हिस्टोसाइटोकेमिस्ट्री और प्रतिदीप्ति-आधारित प्रवाह साइटोमेट्री में किया जाता है। लेबल एंटीबायोटिन एंटीबॉडी का उपयोग बायोटिनाइलेटेड पेप्टाइड्स को बांधने के लिए भी किया जा सकता है। बायोटिन लेबल अक्सर लाइसिन साइड चेन या एन टर्मिनल से जुड़े होते हैं। 6-अमीनोकैप्रिक एसिड को अक्सर पेप्टाइड्स और बायोटिन के बीच एक बंधन के रूप में उपयोग किया जाता है। बंधन सब्सट्रेट के लिए बाध्यकारी में लचीला है और स्टेरिक बाधा की उपस्थिति में बेहतर बांधता है।
9। फ्लोरोसेंट लेबलिंग
फ्लोरोसेंट लेबलिंग का उपयोग जीवित कोशिकाओं में पॉलीपेप्टाइड्स का पता लगाने और एंजाइमों और कार्रवाई के तंत्र का अध्ययन करने के लिए किया जा सकता है। ट्रिप्टोफैन (टीआरपी) फ्लोरोसेंट है, इसलिए इसका उपयोग आंतरिक लेबलिंग के लिए किया जा सकता है। ट्रिप्टोफैन का उत्सर्जन स्पेक्ट्रम परिधीय वातावरण पर निर्भर करता है और घटते विलायक ध्रुवीयता के साथ घटता है, एक संपत्ति जो पेप्टाइड संरचना और रिसेप्टर बाइंडिंग का पता लगाने के लिए उपयोगी है। ट्रिप्टोफैन प्रतिदीप्ति को प्रोटेनेटेड एस्पार्टिक एसिड और ग्लूटामिक एसिड द्वारा बुझाया जा सकता है, जो इसके उपयोग को सीमित कर सकता है। Dansyl क्लोराइड समूह (Dansyl) एक एमिनो समूह के लिए बाध्य होने पर अत्यधिक फ्लोरोसेंट होता है और अक्सर अमीनो एसिड या प्रोटीन के लिए फ्लोरोसेंट लेबल के रूप में उपयोग किया जाता है।
प्रतिदीप्ति अनुनाद ऊर्जा रूपांतरण (FRET) एंजाइम अध्ययन के लिए उपयोगी है। जब FRET लागू किया जाता है, तो सब्सट्रेट पॉलीपेप्टाइड में आमतौर पर एक प्रतिदीप्ति-लेबलिंग समूह और एक प्रतिदीप्ति-शमन समूह होता है। लेबल वाले फ्लोरोसेंट समूहों को गैर-फोटॉन ऊर्जा हस्तांतरण के माध्यम से क्वेंचर द्वारा बुझाया जाता है। जब पेप्टाइड को प्रश्न में एंजाइम से अलग कर दिया जाता है, तो लेबलिंग समूह प्रतिदीप्ति का उत्सर्जन करता है।
10। केज पॉलीपेप्टाइड्स
केज पेप्टाइड्स में वैकल्पिक रूप से हटाने योग्य सुरक्षात्मक समूह होते हैं जो पेप्टाइड को बाइंडिंग से रिसेप्टर तक ढालते हैं। यूवी विकिरण के संपर्क में आने पर, पेप्टाइड सक्रिय हो जाता है, रिसेप्टर के लिए अपनी आत्मीयता को बहाल करता है। क्योंकि इस ऑप्टिकल सक्रियण को समय, आयाम या स्थान के अनुसार नियंत्रित किया जा सकता है, कोशिकाओं में होने वाली प्रतिक्रियाओं का अध्ययन करने के लिए केज पेप्टाइड्स का उपयोग किया जा सकता है। केज पॉलीपेप्टाइड्स के लिए सबसे अधिक इस्तेमाल किए जाने वाले सुरक्षात्मक समूह 2-नाइट्रोबेंजिल समूह और उनके डेरिवेटिव हैं, जिन्हें सुरक्षात्मक अमीनो एसिड डेरिवेटिव के माध्यम से पेप्टाइड संश्लेषण में पेश किया जा सकता है। अमीनो एसिड डेरिवेटिव जो विकसित किए गए हैं, वे लाइसिन, सिस्टीन, सेरीन और टायरोसिन हैं। एस्पार्टेट और ग्लूटामेट डेरिवेटिव, हालांकि, आमतौर पर पेप्टाइड संश्लेषण और पृथक्करण के दौरान चक्रवात के लिए उनकी संवेदनशीलता के कारण उपयोग नहीं किए जाते हैं।
11। पॉलीनटिजेनिक पेप्टाइड (एमएपी)
लघु पेप्टाइड्स आमतौर पर प्रतिरक्षा नहीं होते हैं और एंटीबॉडी का उत्पादन करने के लिए वाहक प्रोटीन के लिए युग्मित किया जाना चाहिए। पॉलीन्टिजेनिक पेप्टाइड (एमएपी) लाइसिन नाभिक से जुड़े कई समान पेप्टाइड्स से बना है, जो विशेष रूप से उच्च पोटेंसी इम्युनोजेन को व्यक्त कर सकता है और इसका उपयोग पेप्टाइड-कैरियर प्रोटीन दोहों को तैयार करने के लिए किया जा सकता है। मैप पॉलीपेप्टाइड्स को मैप राल पर ठोस चरण संश्लेषण द्वारा संश्लेषित किया जा सकता है। हालांकि, अपूर्ण युग्मन कुछ शाखाओं पर लापता या छंटनी पेप्टाइड श्रृंखलाओं में परिणाम देता है और इस प्रकार मूल मानचित्र पॉलीपेप्टाइड के गुणों को प्रदर्शित नहीं करता है। एक विकल्प के रूप में, पेप्टाइड्स को अलग से तैयार और शुद्ध किया जा सकता है और फिर मैप करने के लिए युग्मित किया जा सकता है। पेप्टाइड कोर से जुड़ा पेप्टाइड अनुक्रम अच्छी तरह से परिभाषित है और आसानी से मास स्पेक्ट्रोमेट्री द्वारा विशेषता है।
निष्कर्ष
पेप्टाइड संशोधन पेप्टाइड्स को डिजाइन करने का एक महत्वपूर्ण साधन है। रासायनिक रूप से संशोधित पेप्टाइड्स न केवल उच्च जैविक गतिविधि को बनाए रख सकते हैं, बल्कि प्रभावी रूप से इम्युनोजेनेसिटी और विषाक्तता की कमियों से भी बच सकते हैं। इसी समय, रासायनिक संशोधन कुछ नए उत्कृष्ट गुणों के साथ पेप्टाइड्स को समाप्त कर सकता है। हाल के वर्षों में, पॉलीपेप्टाइड्स के पोस्ट-मॉडिफिकेशन के लिए सी-एच सक्रियण की विधि तेजी से विकसित की गई है, और कई महत्वपूर्ण परिणाम प्राप्त किए गए हैं।
पोस्ट टाइम: 2025-07-03
